-
미국 체외 진단기기 시장동향
- 상품DB
- 미국
- 실리콘밸리무역관 이지현
- 2020-07-28
- 출처 : KOTRA
-
- 코로나19로 체외 진단 서비스와 이와 관련된 의료기기나 장비시장 크게 성장할 것 -
- 한국 기업의 진단 기술력 인정, 2020년 수출 급증 -
□ 상품명 및 HS codeㅇ 상품명: 뒤편을 보강한 진단용ㆍ실험실용 시약과 조제된 진단용ㆍ실험실용 시약(뒤편을 보강한 것인지에 상관없으며 제3002호ㆍ제3006호의 물품은 제외한다), 보증된 참조 물질
ㅇ HS CODE: 382200
□ 배경
ㅇ 체외 진단기기(IVD: In Vitro Diagnostics)는 질병의 진단과 예후, 건강 상태 판정, 질병 치료효과 판정, 예방 등의 목적으로 인체로부터 채취된 대상물(조직세포, 혈액, 소변, 대변, 타액 등)을 이용한 검사에 사용되는 의료기기를 의미함.
ㅇ 체외 진단기기의 종류
기술 분류
주요 내용
분자 진단
인체나 바이러스 등의 유전자 정보를 담고 있는 핵산(DNA, RNA)을 검사해 면역결핍바이러스(HIV), 인유두종바이러스(HPV) 및 암유전자, 유전질환 검사 등에 이용
면역 화학 진단
표본에서 특정 작은 분자의 존재를 검출하고 항원-항체 반응을 이용해 각종 암 마커, 감염성 질환, 갑상선 기능, 빈혈, 알레르기, 임신, 약물남용 등 다양한 질환 진단과 추적에 이용
현장 진단(POCT)
주로 면역학, 임상화학 분야에서 검사하던 것을 환자 옆에서 즉각 검사하도록 함으로써 치료효과를 높이는 데 이용
혈액가스 검사, 심근경색 검사, 혈액응고 검사 등에 이용
자가 혈당 측정 진단
당뇨환자가 혈당의 자가 진단에 활용
혈액 진단
혈액과 골수를 연구하는 분야로 적혈구, 백혈구, 혈소판, 헤모글로빈 등 혈액세포를 검사하는 분야로서 전혈구 검사(CBC)나 응고인자검사에 이용
백혈병, 빈혈, 자가면역질환 등을 진단 또는 치료 후 추적 및 항응고 치료 모니터링에 이용
임상 미생물학적 진단
혈청, 혈장, 소변 등의 검사를 통해 미생물 감염을 진단하고 적절한 항생제 및 투여량을 결정할 수 있는 진단으로 감염에 의한 질병의 진단 및 추적에 이용
조직 병리 진단
인체 조직을 이용해 감염원을 찾아내어 감염에 의한 질병의 진단 및 추적에 이용
지혈 진단
체액 또는 생체조직을 분석해 암 조직이나 세포를 관찰해 진단
자료: 보건복지부
ㅇ 체외 진단기기 기술은 상기와 같이 총 8개의 세부 분야로 나뉘며, 특징 및 진단 가능 질병 들에도 차이가 있음.
ㅇ 상기 8개의 세부 분야 중 현재 주요 분야는 전 세계 시장점유율과 연평균 성장률을 종합해 볼 때, 면역 화학 진단, 분자 진단, 현장 진단, 자가 혈당 측정 진단임.
□ 시장 규모 및 동향
ㅇ 조사 기관마다 조금씩 차이는 있지만 전 세계 체외 진단 시장 규모는 2018년 612억 달러였으며, 예측기간 4.5%의 연평균 성장률(CAGR)로 성장해 2026년에는 880억 달러에 이를 것으로 예상됨(Fortune Business Insights).
ㅇ 북미는 체외 2018년에 230억9000만 달러의 매출을 올렸으며, 2026년까지 예측기간 전 세계 체외 진단 시장에서 우위를 점할 것으로 예상됨.
미국 체외진단기기 시장 규모
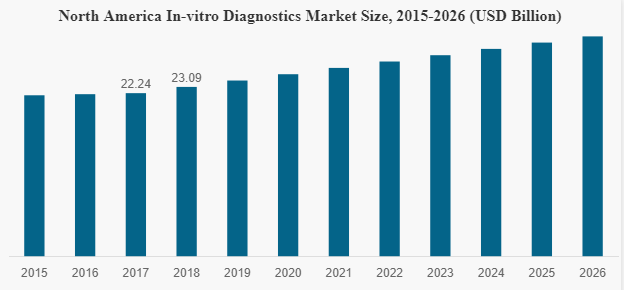
자료: Fortune Business Insights
ㅇ 업계 전문가들은 신속하고 빠른 질병 진단에 대한 수요가 증가하고 있고, 이러한 추세에 맞추어 진단기기에 새로운 기술이 지속적으로 도입되면서 관련 시장이 계속 성장할 것으로 예상함. 그 일례로 POC(Point-of-Care) 장치에 대한 수요가 증가하고, 이를 위해 바이오 칩 및 나노바이오테크놀로지와 같은 첨단기술이 진단기기에 도입되면서 일반인들이 현장 진단에 접근할 수 있는 기회가 확대되고 있으며, 신속하고 유효한 진단 결과가 시장 수요로 이어지는 선순환 구조를 형성하고 있음.
ㅇ 미국 국립 보건원(NIH)에 따르면 2017년 미국에서 약 2350만 건에 이르는 자가 면역 질환 사례가 보고되었고, 미국 보건 복지부(HHS) 통계에 따르면 매년 73만 명 이상의 미국인이 심장 마비로 고통받고 있는 것으로 알려져 있는 바, 각종 전염병의 진단 및 심혈관 질환에 대한 사전 진단에 대한 수요가 증가하면서 미국의 체외 진단기기 시장의 성장에 긍정적 영향을 미칠 것으로 보임.
ㅇ 진단기기의 기술 분야와 관련해서 2019년에는 면역 화학 분석 기반 POC 테스트 결과의 신뢰성과 신속성이 높아지면서 면역 화학 진단 분야가 시장을 지배함.
ㅇ 체외 진단기기의 최종 수요처로 여전히 병원이 가장 큰 시장 점유율을 차지하고 있지만 환자가 직접 집에서 사용하는 홈 케어 부문은 예측 기간 동안 가장 빠르게 성장할 것으로 기대됨.
ㅇ 한편, 전염병이 확산되면 검사 수요가 폭발적으로 증가하므로 관련 시장의 성장에 영향을 미치는 바, 최근 발발한 코로나19 사태로 예방을 위한 사전 진단에 대한 중요성이 대두되면서 장기적으로 시장이 성장할 것으로 보이며, 2019년 11 월 렉슨트 바이오(Lexent Bio)사와 일루미나(Illumina)사가 차세대 시퀀싱(NGS) 기반 암 진단 체외 진단키트를 개발하기 위해 파트너십을 체결하는 등 실험실 기반의 개발이 지속적으로 이루어지고 있어 시장 성장에 긍정적인 영향을 줄 것으로 예상됨. 이외에도 미국의 유연한 규제, 확립된 진단 인프라 등이 요인이 안정적인 시장 여건을 형성하는데 기여할 것으로 보임.
□ 미국의 경쟁동향 및 수입동향
ㅇ 미국 내 경쟁제품
- 체외 진단기기와 관련해 미국에는 에보트(Abbott Laboratoreis), 벡턴 디킨슨(Becton, Dickinson & Company), 존슨 앤 존슨(Johnson & Johnson), 다나허(Danaher, 자회사 Beckman)과 같은 자국 제품을 포함해 로슈(Roche: 스위스), 지멘스(Siemens: 독일)와 같은 글로벌 브랜드 제품이 전체 시장 규모의 대부분을 차지함.
미국 내 주요 경쟁기업의 최신 체외 진단기기 개발 현황
기업명
기술 분야
주요 내용
로슈
(Roche
Diagnostics)
분자 진단
- 코로나 바이러스 진단기기 cobas 6800, 8800 개발
- 분자 진단 매개변수를 감지해 하루에 약 1000~4000명까지 코로나19 테스트 가능
분자 진단
- LightCycler® 480 System 개발
- High-throughput, microwell plate 기반의 Real time PCR
- 특정 미생물이나 바이러스의 감염 여부 혹은 인체 유전자의 이상 유무 등을 진단 및 연구하기 위한 장비
- 빠른 시간 내에 검체에서의 유전자를 정량적으로 파악 가능
면역 화학
진단
- cobas e801 개발
- 2.9㎡ 좁은 공간에서 시간 당 300번 검사를 수행할 수 있어 검사실의 공간 사용 극대화
- 평균 4~60㎕의 적은 검체량으로도 검사가 가능해 환자의 채혈 부담이 적고 대부분의 검사가 18분 안에 종료돼 검사 결과를 신속하게 확인
지멘스
(Siemens
Healthineers)
분자 진단
- 코로나19 검사 위한 Fast Track Diagnostics(FTD) SARS-CoV-2 Assay RUO Testkits 개발
분자 진단
- Hamilton MICROLAB STARlet IVD TPS 개발
- 단일 시약 세트를 사용해 한 번의 추출 과정으로 DNA, RNA 동시 추출 가능
- 4시간 내 최대 48개의 샘플 처리 가능
면역 화학
진단
- IMMULITE 2000 Xpi Immunoassay System 개발
- 일반 검사 작업에 특수 검사 및 알레르기 검사 도입으로 효율성 개선
현장 진단
- RAPIDPoint 500 System 개발
- 터치스크린 인터페이스와 통합 바코드 판독기를 통해 약 60초 내에 스캔, 삽입, 분석 완료
에보트
(Abbott
Laboratoreis)
분자 진단
- ID Now 개발
- 코로나19 모바일 진단기기로 5분 안에 결과를 알 수 있어 긴급 테스트나 일반 개인 병원에 적합
현장 진단
- Abbott i-STAT 1 개발
- 휴대용 혈액 분석기로 대부분 2분 내에 진단 결과 확인 기능 및 전자의료기록(EMR)으로 결과를 전송 가능
플루이다임
(Fluidigm
Corporation)
분자 진단
- Biomark System 개발
- 미세 유체 칩 기술 기반의 디지털 PCR로 통합유체소자회로(Intergrated Fluidic Circuits, IFCs)로 PCR 반응을 자동화하고 형광 신호를 이용해 반응을 검사
바이오 라드
(Bio-rad)
분자 진단
- 코로나19 검사를 위한1-Step RT-ddPCR Advanced Kit for Probes 개발
분자 진단
- QX 200 Droplet Digital PCR
- 액적 기술 기반의 디지털 PCR로 액적 형성기(Droplet Generator)로 액적을 수천나노미터 크기의 입자로 분할한 후 형광신호를 이용해 반응을 검사함
- 검사 가능 시간은 45분 이내로 96개의 샘플을 분석 가능
레인댄스
(Raindance
technologies)
분자 진단
- RainDrop 개발
- BEAMing 기술*기반의 디지털 PCR로 수백만 개 피코리터 입자 내부의 PCR 반응을 검사 (* 비침습적인 체액 생검(liquid biopsy)을 통해 혈액 몇 방울로 실시간 암 진단 및 표적 약물치료의 유전자 변이 확인 가능)
Life
technologies
분자 진단
- 3D dPCR 개발
- 유전자 증폭장치를 이용해 유전자를 증폭시킨 후, 유전자 증폭이 완료된 칩을 광원장치를 이용해 빛을 비추어 유전자와 결합된 형광물질을 검출하는 원리
DRW(Diagnostics for the Real World)
현장 진단
- SAMBA Ⅱ 개발
- LAMP 기술(유전자 증폭법)을 적용해 60분 이내로 진단이 가능
- 샘플처리 과정부터 반응까지 모두 자동으로 제어 실시간으로 반응에 대해 형광신호를 이용해 진단이 가능
자료: 각 기업 웹사이트, 융합연구정책센터 – 차세대 체외진단기기 시장(2020) 자료 참조
- 기술의 발전으로 생명공학기술, 나노테크놀로지, IT 기술이 진단기기와 연계되어 지속적으로 새로운 제품이 출현하는 추세임.
- 동일한 성능을 보이면서도 기기의 소형화, 자동화를 추구하는 경향이 뚜렷함.
- 소량 검사 대상물을 이용해 기존 기기와 동일한 결과를 낼 수 있도록 해 시약 절감, 검사비용 절감 등의 효과를 추구하고 있음.
- 코로나19 진단기기의 경우 현재 유전자 분석 방식에 의한 RT-PCR 방식이 널리 사용되고 있고 이외에도 면역학적 방식의 항원항체 진단키트(신속 진단키트) 개발도 크게 진전되는 상황임.
- 미국의 체외 진단기기 분야는 고부가가치 산업이지만 일부 자가 측정용 기기를 제외하고는 사용자가 안정성과 신뢰성을 중시하는 의사와 임상병리사로 국한되어 후발업체의 시장진입이 어려운 분야에 해당되며, 미국을 비롯한 스위스, 독일 등의 글로벌 진단기기 제조사가 선도적인 입지를 구축하고 있어 시장진입의 장벽이 높음.
- 따라서 신규 업체가 기존의 체외 진단기기 업체와 경쟁하기 위해서는 새로운 기술에 대한 접근성을 향상시키고 제품 공급을 확대하는 것은 물론, 신흥 시장에 우선적으로 진입해 선점 효과를 노리는 등의 전략이 필요함.
ㅇ 수입동향
- HS Code 382200 뒤편을 보강한 진단용ㆍ실험실용 시약과 조제된 진단용ㆍ실험실용 시약(뒤편을 보강한 것인지에 상관없으며 제3002호ㆍ제3006호의 물품은 제외한다), 보증된 참조 물질에 대한 최근 3년간 수입동향을 조사함.
미국의 체외 진단기기 주요 수입국 현황 (HS Code 382200 기준)
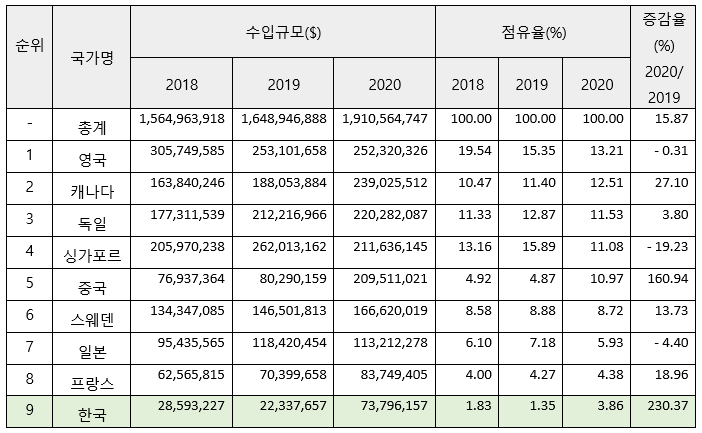
자료: Global Trade Atlas
- 미국의 체외 진단기기 수입규모는 2020년 약 19억 달러로 전년 대비 약 16% 증가함. 미국 시장 내 주요 경쟁업체들의 원산지 국가와 최근 3년간 수입동향을 함께 고려해보면, 주로 주시해야 할 경쟁국가는 캐나다, 유럽, 중국임.
- 체외 진단기기의 한국산 수입은 2020년에 약 7380만 달러로 전년 대비 약 230% 크게 증가했음. 이는 최근 미국에서 코로나19 감염 여부의 진단을 위해 한국산 코로나19 진단 키트를 대규모로 수입했기 때문인 것으로 판단됨.
□ 관세율 및 관련 제도
ㅇ 관세율
- U.S. International Trade Commission에 따르면, HS Code 382200에 해당하는 품목은 세율이 적용되지 않음.
ㅇ 체외 진단기기에 대한 규정
- 체외 진단기기는 연방식품의약품법(Federal Food, Drug and Cosmetic Act) 210(h) 항에 정의된 의료기기임.
- 다른 의료기기와 마찬가지로 용도에 따른 위험 등급 분류 기준에 따라서 각각의 체외 진단기기에 다른 FDA 규정이 적용되고, 시판 전 및 시판 후 통제 대상임.
- 체외 진단 관련 제조업체는 1) 분석 대상 특정 시약(ASR), 2) 실험실 개발 테스트(LDT), 3) 체외 진단(IVD) 시험을 통해 미국 시장에 접근할 수 있음.
시험 유형
규제 기관
규정
판매 형태
ASR
FDA
Medical device regulations
Reagent
LDT
CMS
CLIA(Clinical Laboratory Improvement Amendments) laboratories
Service
IVD
FDA
Medical device regulations
Diagnostic
ㅇ 미국의 차세대 체외 진단기기에 대한 정책
- 세계 각국은 차세대 체외진단기기 산업을 체계적으로 발전시키기 위해 규제를 완화하고 안정성에 관한 정책을 수립, 시행하고 있음.
- 이와 관련해 미국은 새로운 의료기기의 안정성 실행계획(Medical Device Safety Action Plan)을 발표하고 제품수명 전주기에 걸쳐 의료기기의 안전을 관리하도록 함.
- 국가 5대 R&D 중 헬스케어분야를 선정하고 투자를 확대하는 동시에 혁신 의약품 및 의료기기에 대한 허가기간을 단축함.
□ 시사점
ㅇ 미국의 체외 진단기기 시장은 매년 꾸준히 성장해 왔음. 전문가들은 특히 전 세계적으로 창궐한 코로나19사태로 수요가 크게 증가해 체외 진단 서비스와 이와 관련된 의료기기나 장비시장이 크게 성장할 것으로 예상함.
ㅇ 의료 강국인 미국 시장 내 체외 진단기기의 시장 진입은 그동안 매우 어렵고 진입 장벽이 높은 편이었으나 우리 기업의 진단 기술력이 코로나19 사태로 전 세계적으로 인정을 받으면서 2020년 수출이 급격히 증가하는 양상을 보이는바, 차후 다른 진단기기의 시장 진입에도 긍정적인 영향을 미칠 것으로 보임.
ㅇ 시장진출을 위해서는 미국에서 타깃으로 하는 지역 내 폭 넓은 네트워크를 보유한 유망 수입 벤더를 발굴해 약국, 병원 등을 간접적으로 공략해 납품하는 것이 리스크 관리 차원에서 유리함.
ㅇ 전시회는 우리 기업들의 제품에 관심이 많은 바이어들에게 제품을 직접 전시하고 보여줄 수 있는 좋은 기회이므로 적극적으로 참여하는 것이 바람직함. 현재 코로나19 팬데믹 사태로 각종 오프라인 전시회가 취소되면서 어려움이 있지만 온라인 마케팅을 강화하는 등 적극적으로 우리 기업 제품의 우수성을 알린다면 성공적인 시장 진입을 기대해 볼 수 있을 것임.
자료: Global Trade Atlas, 한국 보건 복지부, 미국 보건 복지부, 미국 국립 보건원, Fortune Business Insights, 융합연구정책센터 – 차세대 체외진단기기 시장 보고서, KOTRA 실리콘밸리 무역관 자료 종합
<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>

KOTRA의 저작물인 (미국 체외 진단기기 시장동향)의 경우 ‘공공누리 제4 유형: 출처표시+상업적 이용금지+변경금지’ 조건에 따라 이용할 수 있습니다. 다만, 사진, 이미지의 경우 제3자에게 저작권이 있으므로 사용할 수 없습니다.
-
1
2022년 미국 의료기기 시장 트렌드는?
미국 2021-12-07
-
2
투명한 대응, 위기가 기회로- 독일 체외진단 의료기기시장
독일 2020-04-07
-
3
코로나19 진단키트로 보는 중국 체외진단(IVD)시장
중국 2020-03-13
-
4
프랑스 코로나19 진단키트 시장동향
프랑스 2022-05-24
-
5
포스트 코로나 시대, 체코 체외진단기 시장의 미래는?
체코 2022-10-13
-
6
독일 코로나19 진단키트 시장동향
독일 2020-05-04
-
1
2021년 미국 사이버 보안 산업
미국 2022-01-04
-
2
2021년 미국 의류 산업 정보
미국 2022-01-03
-
3
2021년 미국 엔터테인먼트 및 미디어 산업 정보
미국 2021-12-30
-
4
2021년 미국 자동차 산업 정보
미국 2021-12-30
-
5
2021년 미국 석유 및 정유 산업 정보
미국 2021-12-30
-
6
2021년 미국의 반도체 장비 산업 정보
미국 2021-12-30













