-
[기고] 바이오의약품 할랄 인증의 이해
- 외부전문가 기고
- 인도네시아
- 수라바야무역관 김희철
- 2020-01-08
- 출처 : KOTRA
-
- EPODION 할랄 인증 사례를 통한 바이오의약품 할랄 인증의 이해 -
서창우 대표이사 ㈜대웅인피온, 인도네시아
1. Introduction
1.1 의약품 할랄 필요성과 기회
할랄은 대부분의 한국 사람들이 식품에만 해당된다고 생각하지만 할랄은 먹고 마시고 바르는 즉 사람의 몸 속으로 들어가는 모든 것에 대해서 포괄적으로 적용이 된다. 따라서 모든 의약품은 할랄의 대상이 된다. 인도네시아는 2014년 10월 14일에 법률로 (Halal Products Assurance, UU No 33, 2014) 의약품에 대해서도 5년 이내에 의무적으로 HALAL 인증을 받도록 공포했다(1). 제약사들의 준비 시간이 촉박해 5년 더 연장을 해줘 2024년부터 전면 의무화가 된다. 현재에도 돼지고기와 돼지부설물이 포함된 경우에는 포장물에 반드시 돼지모양 그림의 마크 표기를 해야 한다. 2024년 10월 17일 이후 인도네시아 식품의약청(BPOM) 제품 등록 시 할랄 인증 대상 품목에 할랄 인증이 없을 경우 제품 등록 불가할 방침으로 할랄은 점차 의무화돼 가고 있어 한국 제약사가 할랄을 준비한다면 인도네시아를 포함한 이슬람 국가로 진출에 차별화를 가져올 수 있다.
무이(MUI)는 인도네시아 이슬람 신학자위원회로 전체 인도네시아 63개 이슬람 조직의 협회다. 이 중 무이(MUI)의 하부조직인 LPPOM MUI에서 의약품의 할랄 인증 권한을 가지고 있다. 인도네시아 할랄 인증기관인 울라마 협의회(LPPOM MUI)가 새로운 할랄 인증기관인 할랄 인증청(BPJPH)으로 이관될 예정이다. 향후 3년 이내에 설립할 계획이며, 업무가 이관되더라도 5년의 유계기간이 있다.
일반적인 할랄에 대한 규정, 정보는 앞서 KOTRA와 산업통상자원부 보고서에 상세히 설명돼 있고(2, 3) 할랄 의약품에 대해서는 말레이시아서 나온 가이드라인과 문헌에 잘 설명이 돼 있다(4, 5, 6). 본 연구에서는 바이오의약품 할랄에 대해서 사례를 중심으로 설명하고자 한다.
무엇 때문에 할랄 인증에 관심을 가지고 할랄 인증을 받고자 하는지는 매우 분명하다. 만일 할랄 인증을 받은 의약품과 받지 않은 의약품이 있다면 의사는 할랄 인증을 받은 의약품을 처방해야 하고 환자 역시 할랄 인증이 있는 의약품을 복용해야 한다. 그렇기 때문에 할랄 인증을 받는 경우 더 큰 매출을 확보할 수 있게 된다. 특히 할랄 의약품은 전 세계적으로 매우 초기 단계이기 때문에 할랄 의약품을 출시한다면 차별화된 제품으로 시장을 확보할 수 있게 된다(7).
할랄 인증제도와 할랄 식품에 대해서는 수많은 문헌과 정보들이 있어 여기에서는 그러한 부분은 참고문헌으로 대체하고 할랄 의약품 중에서도 바이오의약품에 한정해 설명하고 사례를 소개하고자 한다.
1.2 바이오 의약품 할랄 사례
무슬림(이슬람 신자)의 경우 할랄 인증을 받지 않은 백신을 거부해 매년 수많은 아이들이 질병에 감염되고 사망하는 사례가 늘고 있다(8). 따라서 바이오의약품에서 할랄 인증은 매우 중요하다. 식품의 경우 다른 할랄 식품을 통해 생명을 유지할 수 있지만 의약품의 경우 할랄 의약품 자체가 없어 대처할 수 있는 의약품이 없기 때문에 환자의 생명과 직결된 문제이다. 인도네시아에서 바이오의약품으로 할랄을 받은 것은 총 5개 제품이 있으며, 해외에서 할랄을 받고 수입된 제품이 3개이고 인도네시아에서 할랄을 받은 2개 제품이 있다(Table 1).
전 세계적으로도 할랄 인증을 받은 바이오의약품이 극소수에 해당하기 때문에 더 많은 바이오의약품이 할랄 인증을 받아 무슬림 환자의 생명을 구해야 한다. 하지만 대부분의 바이오의약품이 비이슬람 국가로부터 개발된 것들이라 할랄 인증에 적합하지 않으며, 할랄 인증을 위해 기허가된 의약품의 전체 공정과 원료를 변경하고 허가변경까지 진행해 할랄 인증을 받는다는 것은 쉽지 않은 일이다. 그러나 할랄이 식품뿐만 아니라 의약품까지 점차 의무화되는 추세이기 때문에 동남아시아로부터 중동과 아프리카로 진출하고자 하는 제약사는 지금부터 할랄 인증을 준비할 필요가 있다. 바이오의약품의 할랄 인증을 받기 위해 무엇을 준비해야 하는지 사례를 통한 설명으로 더 많은 바이오의약품이 할랄 인증을 받아 생명을 구할 수 있기를 바라는 취지에서 작성했다.
Table 1. Halal List of Biological Medicine in Indonesia.
No
Product Type
Host
Manufacturer
Halal No.
1
Group ACYW135 Meningococcal Polysaccharide vaccine
Meingococcal bacteria, conjugate with polysaccharide
Smithkline Beecham Pharmaceuticals
00140055550710
2
Group ACYW135 Meningococcal Polysaccharide vaccine
Meningococcal bacteria, conjugate with polysaccharide
Yuxi Walvax Biotechnology Co., Ltd.
00140080631216
3
Inactivated Influenza Vaccine
Fertile Egg
Hualan Biological Bacterin Co. Ltd.
00140081740317
4
Vaccine Bacillus Calmette-Guerin (BCG)
Bacillus Mycobacterium Bovis
PT. Biofarma
00140095350419
5
Erythropoietin alpa
CHO cell
PT. Daewoon Infion
1.3 할랄/하람에 대한 이해와 오해
1.3.1 할랄 규정의 배경과 이해
할랄에 대한 규정은 이슬람 경전인 코란으로부터 시작되며 모든 무슬림은 몸 안으로 들어가는 모든 음식, 의약품, 화장품은 할랄 인증을 받은 제품을 사용해야 한다. 이는 무슬림의 종교적인 경건함과 건강을 위한 것이다. 비무슬림의 입장에서 오해와 기독교 단체의 반대가 있어 한국의 경우 사회적인 문제로 부상해 할랄 식품, 할랄 화장품 사업이 활성화되지 못하는 요인이 되기도 한다. 또한 유전자 재조합, 세포치료제, 유전자 치료제, 인체조직과 같은 새로운 과학기술로부터 만들어진 의약품이 분명 인간의 질병을 치료하고 생명을 구하는 약임에도 불구하고 종교적인 이유로 허가를 받지 못하는 경우도 있다. 일부 가톨릭 국가의 경우 배아세포를 이용한 세포치료제를 금지하는 것과 이슬람 국가에서 인체조직을 허가하지 않은 것이 그 예이다.
ㅇ Al-Qur’an(코란): 이슬람 경전으로 할랄의 가장 근본이 되며 절대적이다. 알라신께서 질병과 치료법을 만들어 주셨기 때문에 알라신께서 허락하지 않은 방법으로 질병을 치료해서는 안 된다.
ㅇ Al-Hadits(하디스): 코란으로부터 나온 율법으로 모든 무슬림은 반드시 지켜야 한다. 국가에 따라서 일반 법률보다 상위의 개념으로 적용되기도 한다.
ㅇ Ijma Shahabat(샤하밧): 코란과 하디스 해설서로 다양한 언어로 알기 쉽게 설명돼 있다.
ㅇ Qiyas(꾸이야스): 무슬림을 위한 방법서로 종교생활에 필요한 모든 것이 설명돼 있다.
ㅇ Fatwa(파트와): 이슬람 종교 법원으로 위의 규정에 명시돼 있지 않은 새로운 유형의 문제나 시대의 흐름에 따른 변화를 판단한다.
1.3.2 Halal, Haram, Najis에 대한 정의
ㅇ Halal(할랄): '허락된'의 의미로 무슬림은 Halal 인증된 음식, 의약품, 화장품을 먹고 마시고 바를 수 있음. 살아있는 소나 염소는 할랄이 아니다. 도축을 할 때 이슬람율법(Sharia)에 따라 진행된 경우에 할랄이 된다. 할랄 도축 자격증이 있는 사람이 “Bismillah Allahu Akbar”라고 말하고 목에서 동맥을 절단해 피를 빼는 과정을 거치는 것이 이슬람식 도축방법이다.
ㅇ Haram(하람): 금지된의 의미로 무슬림에게 허락되지 않은 것들로 발효알코올, 돼지고기가 대표적으로 알려져 있다. 하람물질을 사용한 경우 절대 할랄 인증을 받을 수가 없다. 인체조직(피부, 뼈, 인대 등)의 경우 하람으로 규정이 돼 이슬람 국가에서 허가가 되지 않는다. 사용하는 원료를 만드는 과정 상에 하람 물질이 들어간 경우에도 할랄 인증을 받을 수 없기 때문에 제조사로부터 확인이 필요하다. 돼지고기는 하람이기 때문에 돼지유래 효소는 하람에 해당된다.
ㅇ Najis(나지스): 불결한 것의 의미로 깨끗이 씻어내 잔류하지 않는다는 것을 입증하면 원료로 사용할 수 있다. 더럽다고 생각되는 모든 것이 여기에 포함된다. 나지스와 하람에 대한 경계가 모호한 부분도 있고 심사관에 따라서 나지스를 하람으로 판단하기도 하다. 따라서 원료가 하람이 아니라 나지스임을 입증하기 위해서 종교학자의 도움이 필요하다.
ㅇ Halal Positive List: LPPOM MUI에서는 정기적으로 할랄 포지티브 리스트를 발표한다. 이는 물, 공기, 흙, 소금, 금속과 같이 할랄 인증이 필요 없는 물질에 대한 리스트로 할랄 포지티브 리스트에 있는 물질의 경우에는 사용이 가능해 할랄 원료임을 입증할 필요가 없다(9).
표 1. 하람과 할랄 물질의 비교표
Haram(하람)
Najis(나지스)
· 돼지고기 및 그 파생물
· 발효 알코올 포함 식품(주류, 알코올 포함 바나나추출물 등)
· 개, 고양이, 원숭이
· 날카로운 이빨을 가진 맹수
· 발톱을 가진 새 및 맹금류
· 더러운 생명체(바퀴벌레, 파리, 구더기 등)
· 죽은 사람·동물의 혈액
· 태반과 같은 인간 신체의 부분 또는 부산물
· 양서류, 노새와 당나귀
· 독이 있거나 위험한 모든 해상동물· 개, 돼지의 파생물
· 비할랄에 의해 오염된 할랄식품
· 비할랄에 직접 접촉된 할랄식품
· 인간이나 동물의 배설물로 모든 액체, 물체, 소변, 혈액, 토사물, 고름, 태반
· 돼지와 개를 제외한 다른 동물의 우유, 정액
· 샤리아법에 의해 도축되지 않은 동물의 고기
· 정신을 혼미하게 하는 음식 또는 음료에 이러한 성분(마약류, 향정신성 의약품 등)이 포함됐거나 혼합된 것(예를 들면 합성알코올이나 정신을 취하게 만드는 것)
· 이슬람교도가 죽이지 못하도록 하는 동물, 벌 딱따구리 등2. Material and Method
2.1 할랄 품질 관리
할랄 품질관리를 위해 HAS23000에 상세하게 규정돼 있다(1,10). HAS2300과 GMP를 별도로 운영할 경우 이중 작업이 될 수 있기 때문에 GMP 품질관리와 통합해 운영했다. 할랄 품질관리인 HAS2300과 GMP 품질관리를 다음과 같은 방식으로 통합했다(Figure 1).
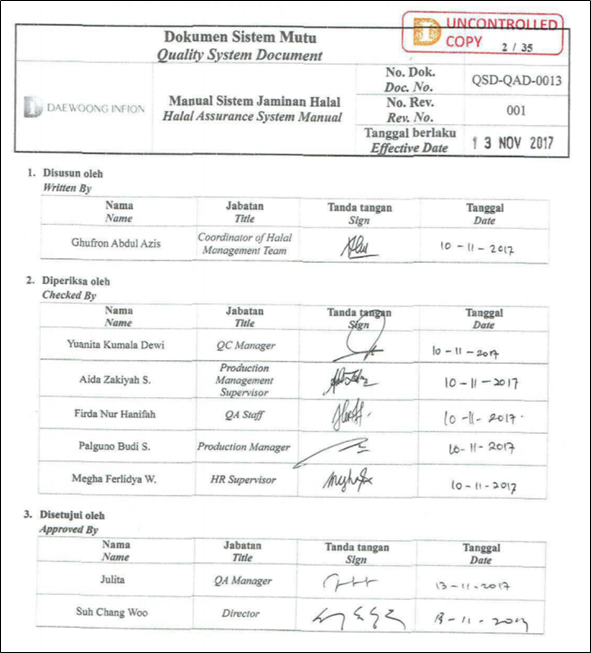
Figure 1. Halal Assurance System of EPODION.
ㅇ Halal Policy(할랄 정책): 할랄 제품을 생산하는 공장의 운영에 대한 정책을 정의한다.
ㅇ Halal Management Team(할랄 운영팀): GMP 조직도에 공장장 직속으로 할랄 운영팀을 둔다. 할랄 운영팀은 생산팀, QC팀, QA팀, 생산관리팀, 공무팀보다 상위의 권한을 가지는 팀이다. 팀장은 무슬림으로 두는 것이 바람직하다.
ㅇ Training and Education(훈련 및 교육): LPPOM MUI에서 규정한 할랄 정기 교육이 있고 할랄 제품을 생산하는 전체 직원을 대상으로 시행하는 할랄 교육으로 구성된다. 매년 MUI에서 HAS 23000 교육을 시행하며, 교육을 이수 후 인증서를 받아 보관해야 한다. 전직원 대상 교육은 GMP 교육 시에 같이 수행하는 것이 좋다.
ㅇ Materials(원료): 사용된 모든 원료(소모품, 포장재 등 포함)에 대한 리스트가 필요하며, 할랄 인증 시 등록된 원료로만 생산을 해야 하고 원료의 변경 시 MUI에 승인을 받아야 한다. GMP 상의 원료 변경같이 USP 원료인 경우 자체 변경 후 정기 약사감시 때에 보고하고 실사를 받으면 되나 할랄 원료의 변경의 경우 즉시 변경 신고를 해야 한다.
ㅇ Product(제품): 할랄을 인증받는 제조소에서 생산되는 모든 제품은 할랄의 규정을 준수해야 한다. 할랄과 비할랄 제품을 같이 제조할 경우 실사를 통과하기 힘들다. 바이오제품은 제품생산 과정이 복잡하니 Flow diagram으로 상세하게 설명하는 것이 필요하다.
ㅇ Production Facility(생산소): 할랄 제품과 비할랄 제품은 가능하면 분리된 제조소에서 생산하는 것이 좋다. 절대 혼입되지 않고 용기 등을 같이 사용하지 않는 것을 입증하는 것이 더 어렵다. 할랄 전용공장을 운영하고 GMP에서 dedicated facility의 개념을 적용해야 한다. 공조, 용수, 사람, 원료, 설비, 동선 등이 모두 분리돼야 한다.
ㅇ Written Procedures of Critical Activities(문서화된 방법서 및 주요 활동): GMP 문서인 SOP, WIS, Form, Report에 할랄 규정을 포함해 통합 운영하는 것이 바람직하다. Critical Activities는 IPC 설정의 근거와 과학적인 접근 내용을 기술하고 SOP에 반영하면 된다. 특히 Najis가 제거되는 공정에 대해서는 명확히 설명되고 IPC가 됨을 입증해야 한다. 이는 Cleaning validation과는 다르고 Endotoxin, virus clearance validation과 같은 개념으로 보면 된다.
ㅇ Traceability(추적관리): GMP의 Batch Record(조제기록서)와 QC에서 Audit tray의 개념으로 보면 된다. 즉 모든 활동에 대한 기록을 남겨 사후에 원인을 파악할 수 있도록 하면 된다. 최근에 CCTV, Building Monitoring 시스템을 적용한 제약사가 점차 늘고 있어 추적관리는 보통의 제약회사 수준이면 충분하다.
ㅇ Handling of Out of Specification Products(이탈 제품의 처리): GMP상의 OOS에 대한 규정에 할랄의 이탈을 포함해 관리하면 된다. 바이오의약품은 대부분 무균주사제이기 때문에 제품의 이탈 시에는 폐기를 기본으로 한다고 하면 가장 명확하다.
ㅇ Internal Audit(내부 실사): GMP상의 내부실사에 할랄에 대한 부분을 포함해 진행하는 것이 바람직하다. 내부실사자는 QA팀과 할랄 운영팀에서 같이 참여하면 된다. 내부 실사 후 지적사항에 대해서는 CAPA 계획을 수립하고 이행하는 것 또한 GMP 운영 방식과 동일하다.
ㅇ Management Review(검토): 정기적인 GMP 위원회를 개최해 하나의 안건으로 할랄에 대한 부분을 다뤄야 한다. 이때 할랄 품질 전반에 대한 것을 점검해 보고해야 한다. 교육, 원료의 관리, 할랄제품의 생산, 이탈 보고, 내부 실사 결과 등을 포함한다.
2.2 바이오 의약품 할랄 인증을 위해 고려할 사항
2.2.1 바이오 의약품을 위한 특별한 할랄 규정은 없다.
바이오 의약품에 대한 할랄 규정이 별도로 있는 것이 아니기 때문에 기존 식품에서 적용되는 할랄 심사 규정을 따라서 하람 원료를 사용하지 않았다는 것과 나지스는 공정 중에서 깨끗하게 제거가 됐다는 것을 입증해야 한다. 제품에 들어가는 부형제의 경우 할랄 인증을 받은 것들이 많이 있어 가급적이면 할랄 인증을 받은 부형제를 사용하는 것이 좋다. 준비를 할 때 의약품 GMP에 준하는 서류를 준비해야 한다(Figure 2).
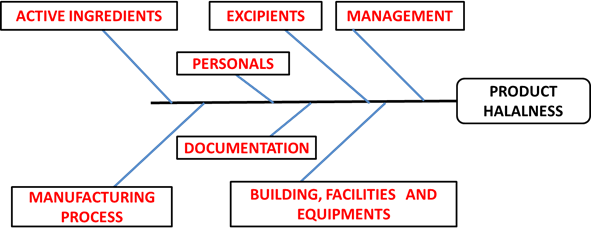
Figure 2. Cause-Effect Diagram for Factors influencing the product halalness.
2.2.2 바이오 기술에 대한 이해가 중요하다.
할랄을 심사하는 분은 종교지도자, 대학교수, 의사, 약사와 같은 다양한 분야의 최고 전문가가 참여해 실사를 한다. 하지만 우리가 기대하는 만큼의 바이오에 대한 전문지식을 가지고 있다고 생각하면 전체 과정이 매우 어려울 수 있다. 중학교 생물 교과서 수준으로 아주 쉽고 이미지화해서 준비하는 것이 좋다. Recombinant Human DNA란 단어에 매우 민감하다. 인체유래 물질을 사용하면 할랄 인증을 받을 수 없고 GMO(Genetically Modified Organism) 작물과 동일하게 취급 받을 수 있다. GMO와 LMO(Living Modified Organism)가 어떻게 다른지를 할랄 관점에서 누구나 이해할 수 있도록 설명할 수 있어야 한다.
2.3 원료공급사 자료 확보(Halal 원료, 비할랄 원료)
2.3.1 할랄 원료에 대한 인증서 확보
최종 제품에 사용되는 부형제의 경우 할랄 인증을 받은 것들이 많다. Aldrich-Sigma사의 경우 독일에 할랄 전용공장을 두고 할랄 제품을 생산해 공급하고 있다. 할랄 원료에 대해서는 반드시 인증서를 확보해 제출할 수 있도록 한다(Figure 3).

Figure 3. Halal Certification of Sodium hydroxide Material.2.3.2 바이오의약품 생산에 사용된 비할랄 원료
바이오의약품 생산에는 세포주(대장균, 효모, 동물세포), 재조합 유전자, 다양한 동물유래 원료, 알코올 유래의 비할랄 원료가 사용된다. 심지어는 자체적으로 만든 유전자 재조합 효소를 사용한다면 두 배의 준비를 각오해야 한다. 발효알코올은 Haram으로 공정에 사용하면 안 된다. 하지만 합성알코올은 Najis로 공정에 사용 후 제거를 했다는 것을 입증하면 된다. 잔류 알코올 불검출이 원칙이나 과학적으로 100% 제거란 없기 때문에 LOD(검출한계) 이하로 관리하면 된다. 소독을 위한 알코올 역시 제품과 접촉하지 않는다는 것을 공정에서 입증해야 한다. 깨끗하고 맑은 물은 할랄이지만 오염된 물은 Najis에 해당된다. 따라서 주사용수나 정제수에 염을 첨가한 버퍼(Buffer)가 오염된 물이 아니란 것을 입증해야 한다.
바이오 의약품을 생산을 위한 세포주(MCB, WCB)를 개발할 때 돼지 트립신을 사용했다면 할랄을 받을 수가 없다. 따라서 MCB와 WCB를 소 트립신으로 바꿔 새롭게 만들어야 한다. 동물배지의 경우 돼지 유래 성분이 아닌 경우는 세포배양 시에 사용된 이후 정제공정을 통해 완전히 제거된다는 것을 입증해야 한다. 돼지유래 성분이 있다면 바꿔야 한다. 사람 유전자를 사용했다고 하면 누구로부터 추출했는지를 묻는다. PCR을 설명하는 것도 쉽지 않으니 다양한 그림과 동영상을 준비해 이해를 시킬 수 있어야 한다.
CHO cell을 이용한 항체와 같은 바이오 제품의 생산이라면 CHO cell이 하람 또는 나지스가 아니란 것을 입증해야 한다. 쥐는 하람이며 쥐 유래 물질은 나지스에 해당하기 때문이다. 햄스터와 쥐는 생김새가 매우 유사하며 같은 설치류이다.
동물유래 원료를 사용할 경우(혈청, 효소 등) 돼지유래가 아님을 반드시 입증해야 한다. 간혹 제조사에서 상세한 배지성분을 알려주지 않은 경우도 있다. 이럴 경우 입증이 불가능해 할랄을 받을 수가 없다. 반드시 제조사의 서명과 직인이 있는 공문을 통해 제조과정에 하람성분이 일체 사용되지 않았고 접촉되지도 않았다는 것을 받아야 한다.
동물유래 원료를 사용할 경우 돼지유래 성분만 없다고 다 허용되는 것은 아니다. 만일 해당 동물을 Sharia법을 따라 도축하지 않았다면 나지스가 된다. 따라서 완전히 제거됨을 입증해야 한다. FBS처럼 살아 있는 동물로부터 혈액을 채취된 경우에는 나지스가 아니다. 죽은 사람의 혈액은 수혈이 불가능하지만 산 사람으로부터 채취된 혈액은 수혈이 가능한 이유이다.
합성원료의 경우에도 잘 알려지지 않은 원료에 대해서는 생산공정 중에 하람물질이 사용되지 않음과 나지스가 모두 제거됐다는 것을 요구한다. 따라서 제조사에 요청해 공문과 제조공정에 대한 설명을 받아야 한다. DEAE, DMSO와 같은 식품에서 거의 사용된 예가 없는 생소한 원료에 대해서는 미리미리 설명 자료를 준비해 두는 것이 좋다.
3. EPODION 할랄 인증 사례
EPODION은 ㈜대웅인피온(PT. Daewoong Infion, Pandaan, Jawa Timur, Indonesia)에서 개발한 유전자재조합 Erythropoietin (EPO, 적혈구생성인자)의 바이오시밀러 제품이다. CHO 세포를 이용한 동물세포배양 통해 EPO 단백질을 만들어내는 바이오의약품의 대표적인 의약품이다. EPODION의 할랄 인증 과정에서 수많은 질문에 답변과 근거자료를 제출하면서 진행된 할랄 인증 과정을 시간순으로 기술하고자 한다. 전 세계적으로 동물세포배양 재조합 바이오의약품의 할랄 인증 첫 번째 사례인 만큼 항체, 백신, 성장인자의 할랄 인증에 도움이 되고자 한다. EPODION은 2000, 3000, 4000, 10000IU의 4가지 바이오시밀러 제품과 같은 용량의 4가지 제네릭 제품 그리고 DS(Drug Substance)로 구성돼 총 9가지 제품에 대한 할랄 인증을 신청했다(Figure 4).
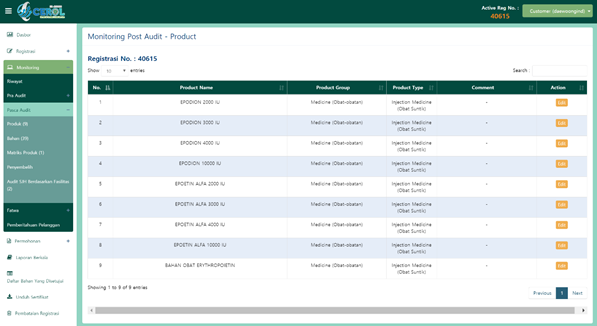
Figure 4. Applied Halal Product List in Cerol System.
일반적인 할랄 인증은 다음의 절차에 따라 진행된다.
ㅇ HAS Preparation: Company set up and implement HAS
ㅇ On line registration CEROL SS2300: visit website: www.halalmui.org
ㅇ On site audit: Visit to the factory
ㅇ Auditor Meeting: Report result audit by LPPOM MUI Auditor
ㅇ Laboratory analysis; If it is necessary
ㅇ Fatwa Committee Meeting: Halal legal opinion of the product
ㅇ Issued Halal Certification and HAS implementation status.
3.1 할랄 인증 준비단계
EPODION 제품을 인도네시아에서 2016년 12월에 허가를 받고 국가 의료보험제도인 BPJS에 2017년 3월에 등재돼 2017년 4월부터 인도네시아에 정식 판매를 했다. 의약품의 경우 인도네시아 식약처(BPOM)의 허가를 받기 이전에는 할랄 신청을 할 수 없기 때문에 제품 발매와 함께 공식적인 할랄 인증 작업에 착수했다. 의약품에 대한 할랄 인증 사례조차 매우 적은 상황에서 동물세포 유래 바이오의약품에 대해서는 인도네시아 할랄 인증기관(LPPOM MUI)뿐만 아니라 세계적으로 사례가 없었기 때문에 EPODION 제품의 할랄 인증은 쉽지 않은 도전이였다.
그러한 이유로 할랄 준비를 위한 회사 내 할랄팀을 구성하고 기존 식품 분야에서 할랄 인증을 도와주는 컨설팅 회사와 미팅을 진행했다. 2017년 4월부터 PT. Bintang Solusi사와 Change Consultant사 등과 미팅을 진행하며, 할랄 인증에 필요한 사항과 컨설팅 회사가 도와줄 수 있는 분야를 논의했다. 문제는 바이오의약품에 대한 경험이 전무해 일반적인 할랄 인증 프로세스와 교육에 대한 도움을 받을 수 있었다.
2017년 4월과 6월에 인도네시아 할랄 인증기관(LPPOM MUI, 자카르타 남쪽 보고르 소재)에 방문해 직접 컨설팅을 받게 됐다. 대략적인 EPODION 제품에 대한 설명과 바이오의약품 생산 공정에 대한 이해를 갖도록 했으며, 이를 통해 FBS(Fetal Bovine Serum), 생산세포주(CHO cell), 주사용수(WFI), Human EPO DNA 등이 문제가 될 것이란 것과 명확한 법이나 규정이 없는 경우 및 유사한 사례가 없는 경우에는 이슬람 법정과 같은 Fatwa 위원회에 판단을 요청한다는 것을 알 수 있었다. 주사용수가 포함된 이유는 모든 Najis를 제거할 때는 통상적으로 순수한 물을 사용하고 다량의 물로 씻어내야 제거됐다고 인정하는데 EPODION 정제공정에서는 주사용수에 여러 가지 염(salt)가 들어간 버퍼(Buffer)를 사용하고 크로마토그래피에서는 다량의 물로 씻어낸다는 개념과 조금 다르기 때문이다.
회사 내 할랄팀을 통해 할랄 인증에 대한 학습을 매주 진행하고 의약품에 대한 할랄 인증 사례를 수집했다. 특히 말레이시아의 의약품 할랄 인증 사례가 큰 도움이 됐다(4, 5). 준비단계에서 가장 중요한 것은 할랄팀 구성원의 확고한 의지와 확신을 갖는 것이다. 왜냐하면 수년이 소요될 지루한 싸움과 예측하지 못했던 문제들이 발생하더라도 절대 포기하지 않고 끝까지 어려움을 극복할 수 있어야 한다.
3.2 할랄 문서 준비 및 온라인 접수
모든 할랄 인증은 온라인 시스템(CEROL-SS23000, www.e-lppommui.org)으로 접수부터 승인까지 모든 과정이 투명하게 운영이 된다. 할랄 인증 신청을 위해서는 아래와 같은 13가지의 서류를 준비해야 한다. 할랄 신청이 처음인 대웅인피온은 처음 두 가지를 제외한 총 11가지 서류를 준비했다.
ㅇ (기존 할랄 인증서 보유회사 해당) 할랄 인증서
ㅇ (기존 할랄 인증서 보유회사 해당) 할랄 보장 시스템 등급, 할랄 보장 시스템 인증서
ㅇ 할랄보장 시스템(HAS 23000) 매뉴얼: GMP 규정과 연동해 준비
ㅇ 할랄 인증 제품의 생산 공정도: 최대한 이해 가능하도록 Flow chart를 활용해 설명
ㅇ 돼지성분을 사용하지 않는다는 확인서
ㅇ 모든 생산 시설의 주소
ㅇ 할랄 정책 배포 증거: 대표이사 또는 공장장 서명 후 전 직원 대상 공지
ㅇ 할랄보장 시스템 외부교육(LPPOM MUI 주체) 증거: 교육이수 후 인증성 확보
ㅇ 할랄보장 시스템 내부교육 증거: 자사내 교육 후 교육자료, 참석자 서명 확인
ㅇ 할랄 인증대상 제품목록: EPODION 4개 제품, EPO 제네릭 4개 제품
ㅇ 할랄 인증대상 재료목록: EPODION DS(Drug Substance) 1개 품목
ㅇ 원재료 증빙서류: 제조사로부터 가능한 많은 정보를 받음.
ㅇ 할랄 인증대상 재료 매트릭스: 각각의 원료의 제조사, 원료 이름, 원료 성분, 원료 설명, 제품코드, 제조국가, 공급사, 할랄 인증 원료의 경우 할랄 유효기간, 할랄 인증번호, 생산배치번호, 인증기관 등의 정보를 표로 만듦.
모든 할랄 서류를 준비해 2017년 10월에 CEROL 시스템에 회사를 등록하고 심사비용 지불 후 11종 서류를 모두 업로드했다. 이후 할랄 심사는 Figure 5와 같은 순서에 따라서 진행이 되며 지원한 회사와 심사기관의 역할을 잘 인지해 대응해야 한다. 심사비용은 100만 원 정도 한다. 물론 거절당하거나 심사기한을 넘겨 종료될 경우 심사비용은 반환하지 않는다.
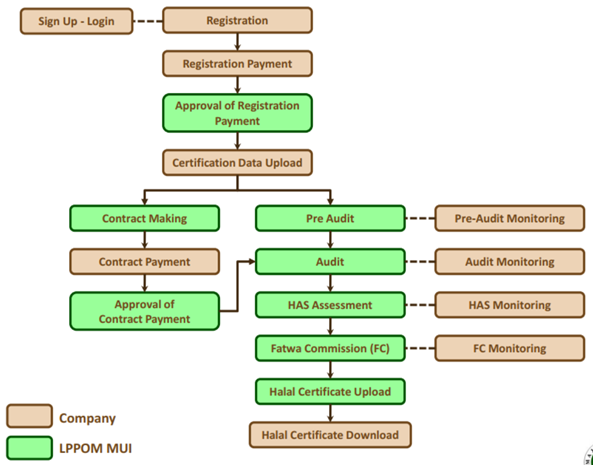
Figure 5. Halal Registration Process Flow Chart.
3.3 선허가(Pre Audit) 진행
바이오의약품의 할랄 심사에서는 전체 과정 중에 선허가 과정이 가장 중요하고 오랜 시간이 소요된다. 선허가는 제출된 문서로 심사를 진행하는 단계로 모두 온라인 시스템에 업로드하고 심사진행 사항을 언제든 확인할 수 있다. 선허가 심사 중에 우려했던 원료물질에 대한 수 많은 추가 자료요청을 받았다. CHO cell을 살아있는 햄스터로부터 얻었는지 햄스터를 죽인 후 채취했는지에 대한 질문에 답을 구하는 것을 쉽지 않은 일이었다. Chines Hamster는 기록상 1948년에 북경에서 샌프란시스코로 이동했다. Chines Hamster의 역사를 추적해 누가 언제 어떻게 CHO cell line을 만들고 어떻게 여러 회사에서 상업적으로 개발해 판매하고 있는지에 대한 히스토리를 잘 정리해야 한다. 본 제품의 DS인 human Erythropoietin를 만드는 과정의 설명을 DNA 합성에서 PCR을 거쳐 다시 CHO cell 안으로 넣어 MCB(Master Cell Bank)을 만들고 WCB(Working Cell Bank)를 만든 과정을 설명하고 이해시키기 위해 오랜 시간이 소요됐다.
EPODION을 생산하기 위해 사용되는 원료 중에 39개가 추가 자료를 요구하는 대상이 돼 각각 원료에 대한 제조사의 자료를 포함해 설명했다(Figure 6). 제품에 사용된 원료는 Erythropoietin DS를 제외하고는 모두 할랄 인증이 있는 부형제를 사용했으며, DS를 생산하는 공정에 사용된 할랄 인증이 없는 합성물질의 경우에는 정제공정에서 모두 제거돼 제품에 포함되지 않는다는 것을 다양한 시험결과를 통해 입증했다. 컬럼공정에 사용되는 DEAE, Filter의 경우에도 제조사로부터 생산방법과 사용된 원료에 대한 정보를 받고 일일이 Porcine DNA 테스트를 진행해 돼지유래가 아님을 제시할 정도로 새로운 물질인 경우에는 심사관이 아주 깊게 조사를 하니 사전에 준비를 많이 해야 한다. 제한된 기간 안에 자료를 제출하지 못할 경우 심사는 자동으로 종료되고 처음부터 다시 절차를 진행해야 한다. EPODION의 경우에도 심사기한 초과로 종료된 경험이 있다.
Figure 7. Applied Material List in Cerol.
의약품 GMP를 이미 받은 공장이기 때문에 설비, 장비, 직원교육, 기록서, 품질시스템 등에서는 보완사항이 없었다. 이는 제약공장의 GMP 수준이 식품에서의 할랄 인증보다 더 엄격히 관리되고 있기 때문이다.
바이오의약품에서 가장 어려운 부분은 역시 동물유래 원료 물질이다. 동물세포를 배양하기 위해서는 동물유래 성분이 있는 배지를 최초 사용했고 제조사로부터 배지조성물과 비율을 요청했으나 제조사의 기밀에 해당하는 정보로 제공할 수가 없다는 답변을 받았다. 어떤 동물유래 성분을 사용했고 어떤 동물에서 유래된 것인지에 대한 간략한 정보가 전부였다. 그러나 LPPOM MUI에서는 각 동물유래 성분의 제조과정까지 상세한 정보를 요청했다. 결국 배양배지를 비동물성 유래로 변경했다. 이를 위해 연구단계에서 다양한 배지를 대상으로 시험을 하고 Pilot 생산과 Process Validation을 수행해 변경허가를 받아야만 했다. 이는 매우 위험한 시도이다. 동물유래 배지를 사용하는 공정이라면 할랄 인증을 위해 배지변경을 사전에 준비하거나 제조사로부터 충분한 데이터를 제공받아야만 한다. 대장균을 이용한 발효공정에도 Defined media가 아닌 Yeast Extract와 같은 혼합 원료를 사용할 경우 모든 효모유래 물질이 제거됨을 입증해야 하고 소 유래 단백질 가수분해 물질이더라도 해당 소를 도축할 때 대부분 할랄 방식을 따르지 않았기 때문에 단백질 가수분해 물질은 나지스가 되어 공정 중에 완전한 제거가 됐다는 것을 별도로 입증해야 한다. 이는 잔류 HCD(Host Cell DNA)와 HCP(Host Cell Protein)를 측정하는 것과 같은 원리이다.
3.4 파트와 위원회(FATWA Committee)
선허가에서 LPPOM MUI에서 심사관들이 할랄이 가능한지에 대한 판단이 어려운 경우 파트와 위원회에 상정해 결정을 받는다. 한국의 식약처에 허가를 받을 때 식약처 단독으로 결정이 어려운 경우 중앙약사심의위원회에 결정을 따르는 것과 유사하다고 생각하면 된다. 통상적으로는 본허가를 완료한 이후 최종 할랄 인증을 파트와 위원회에서 할랄 증서를 교부하는 역할을 하나 LPPOM MUI로부터 요청이 있는 경우 위원회를 개최해 최종 의사결정을 한다.
EPODION 선허가 과정에서도 CHO cell이 햄스터 자궁에서 유래한 것이라 햄스터가 쥐인가 아닌가에 대한 결정, Erythropoietin을 만들기 위한 인간 유전자를 사용한 것이 하람인지 아닌지에 대한 결정이 파트와 위원회에 상정됐다. 2019년 8월에 파트와 위원회에서 40여 명의 위원들로부터 3시간 동안의 질의응답을 거치고 다시 소위원회를 개최해 최종적으로 할랄 의약품 원료로 사용할 수 있다는 결정을 받았다(Figure 8).
파트와 위원회는 종교적인 의사결정 기구인 만큼 과학적인 접근만으로는 설득시키거나 이해시키기가 어렵다는 것을 전제해야 한다. 모든 과학적인 데이터를 종교적인 관점에서 재해석을 하고 종교지도자와 종교학자들을 통해 공식적인 의견서를 받아서 제출한 것이 좋은 결과를 가져왔다고 생각한다.

Figure 8. Meeting in the Fatwa Committee.
3.5 본허가(Audit) 진행
선허가가 끝나면 본허가로 넘어가게 되며, 이는 공장실사를 통해 선허가 때 제출한 문서들에 대한 현장 확인으로 이미 할랄 허가를 받은 공장에서 제품이 추가되는 경우에는 실사는 하루로 끝나지만 처음 실사를 받는 공장이라면 3일 정도 소요가 된다. 첫째날은 회사 또는 공장에 대한 소개, 제품 생산공정에 대한 설명, 공장 운영과 할랄 품질관리에 대한 설명, 공장 현장 투어를 시행하고 둘째날은 문서점검을 한다. 온라인 시스템으로 전자문서를 업로드했기 때문에 문서 점검 때에는 꼭 제출한 것과 동일한 원본문서를 제공해야 한다. 버전 관리를 잘 못해서 전자문서와 원본문사가 동일하지 않은 것이 발견이 되면 큰 낭패를 당할 수 있다. 마지막 날에는 부족한 심사를 추가적으로 수행하거나 앞서 이틀간 심사에 대한 결과를 설명하고 결과보고서에 대한 양자 서명을 한다(Figure 9). 본허가 실사는 한국 식약처의 GMP 실사나 정기 약사감시를 준비하듯이 하면 된다. 묻지 않은 것에 대한 답변을 하지 않도록 직원 교육을 잘하는 것이 중요하다. 실사관들은 수십 년간 실사경험을 가지고 있는 고수들이기 때문에 의욕이 앞선 직원들은 유도질문에 쉽게 넘어간다. 할랄 실사에 들어가는 교통, 숙박, 식사는 모두 실사를 받는 회사에서 제공해야 한다. 어느 나라이던 의전을 잘해서 나쁠 것은 하나도 없다.
EPODION 본허가를 위한 공장실사는 2019년 12월 진행됐으며 12가지 항목에 대한 실사에서 다행히 3가지의 보완사항을 받는 것으로 매우 성공적으로 실사를 마무리했다.

Figure 9. Report of Halal Audit Result.
실사 후 보완사항에 대해서는 한 달 이내에 공식적으로 통보가 오지만 그 전에 보완자료를 준비해서 통보를 받은 즉시 접수를 하는 것이 바람직하다. 보완자료 제출은 GMP 실사 후 진행하는 CAPA(Corrective Action and Preventive Action)와 유사한 절차이다. 또한 본허가를 LPPOM MUI 내부에서 진행하는 중에 궁금한 점에 대해서는 실사관을 통해 이메일이나 전화로 추가 문의가 오기도 한다. 공식적인 답변 요구는 아니지만 성실하게 준비하여 답변하는 것이 좋다.
3.6 할랄 인증서 교부
본 허가까지 완료하게 되면 최종적으로 할랄 인증을 파트와 위원회에서 결정한다. 파트와 위원회는 통상 매월 한번씩 개최하나 한 번에 많은 안건이 상정되지 않기 때문에 몇 달을 기다려야 할 수도 있다. EPODION 제품에 대한 본허가 통보를 2019년 12월에 LPPOM MUI로부터 받고 제품샘플 제출을 했다. 그리고 2020년 1월에 파트와 위원회에서 최종 승인과 할랄 허가증이 발급됐다(Figure 10). 할랄 인증서는 할랄 허가를 받은 후 3주 이내에 Cerol 시스템에서 확인할 수 있고 다운로드 받을 수 있다. LPPOM MUI에서 발급하는 할랄 인증서의 유효기간은 2년이며, 향후 BPJPH로 이관된 이후에는 4년으로 늘어날 예정이다.

Figure 10. EPODION Halal Certification from LPPOM MUI
4. Conclusion
바이오의약품의 할랄 인증에 대한 규정과 준비할 사항을 EPODION 할랄 인증을 사례로 설명했다. 한국과 같은 비이슬람 국가에서 할랄 의약품을 준비한다는 것이 쉽지 않은 일인 것은 분명하다. 아직 의약품 할랄 인증받은 제약사가 없고 기존 할랄 인증을 도와주는 기관들은 대부분 식품 분야에 집중돼 있기 때문이다. 의약품에 대한 할랄 인증은 이제 시작되는 단계이기 때문에 지금 준비를 시작한다면 분명 차별화된 전략으로 이슬람 시장에 진출할 수 있고 좋은 결과를 가져오리라 확신한다. 무슬림의 의약품 시장은 2015년에 US$ 78 billion에 이르며 세계 의약품 시장의 7%에 해당한다고 한다(11).
특히 바이오의약품의 할랄 인증 사례 자체가 희귀한 상황이니 바이오품목을 가진 제약사라면 인구 18억의 무슬림 시장을 독점할 수 있는 기회인 만큼 대웅인피온의 EPODION 사례가 국내 제약사의 바이오의약품 할랄 인증에 조금이라도 도움이 되기를 바랍니다. 많은 무슬림이 할랄 인증이 없는 백신을 거부함으로 인해 매년 많은 아이들이 생명을 잃고 있다(12). 이슬람 국가와 무슬림 단체에서 할랄 백신을 강력하게 요구하고 있는 상황이나 다국적 백신 제약사로부터 외면당하고 있다.
백신뿐만 아니라 질병을 치료하는 많은 바이오의약품이 할랄 제도를 이해해 개발단계에서부터 할랄 인증을 고려한다면 더 많은 생명을 구하고 더 큰 시장을 얻을 수 있기 때문에 이제 바이오의약품에서의 할랄은 선택이 아니라 필수라고 생각한다. EPODION 사례가 미약하지만 큰 변화를 위한 작은 울림이 되기를 바랍니다.
5. 감사
EPODION 할랄 인증을 위해 3년간 포기하지 않고 이끌었던 대웅인피온 할랄팀에 진심으로 감사의 말씀을 드립니다. 또한 대웅인피온 회사까지 찾아와 도움을 주신 한국 대사관 직원분들과 KOTRA 직원분들께도 이 기회를 통해 감사의 말씀을 드립니다. 해외에서 사업하시는 많은 한국 기업과 직원분들의 성공을 기원합니다.
6. 참고문헌
1. President of Republic of Indonesia, Law Concerning Halal Product Assurance by the Grace of GOB Almighty, Law of Republic of Indonesia No. 33, 2014.
2. 허유진, 오유진, 복덕규, 인도네시아, 말레이시아 할랄시장 진출전략, Global Market Report 18-037, KOTRA, 2018.
3. 정창근, 김중관, 대 이슬람권 할랄산업의 수출활성화 정책 연구, 산업통산자원부, 2015.
4. Halal pharmaceuticals: General requirements (First revision), ICS: 11.120.99, Department of Standards Malaysia, 2018.
5. N. Ramli, F. Salleh, S.M.N. Azmi, HALAL PHARMACEUTICALS: A REVIEW ON MALAYSIAN STANDARD, J. Arts and humanities, 1(1), 137-142, 2012.
6. M. A. Halim, M.I. Kashim, M. M. Salleh, A.B.M. Husni, Halal Pharmaceuticals, The Social Sciences, 10(4), 490-498, 2015.
7. 글로벌 식품 신시장 할랄, 삼정KPMG 경제연구원, 2015.
8. A. Asmak, S. Fatimah, I. Huzaimah, A.H. Khuriah and A.M. Siti Khadijah, Middle-East Journal of Scientific Research 23 (3): 367-373, 2015.
9. Halal Positive List of Materials, SK07/Dir/LPPOM MUI/I/13, 2013.
10. General Guidelines of Halal Assurance System 4th Edition, LPPOM MUI, 2008.
11. State of the Global Islamic Economy Report 2016/17, Thomson Reuters Islamic Finance, 2016.
12. N.A. Hak, N.M. Hashim, Protecting the Health of Children by Mandating Vaccination and Immunization, International Journal of Academic Research in Business and Social Sciences Vol. 9 , No. 5, May, 2019.
※ 해당 원고는 외부 전문가가 작성한 정보로 KOTRA의 공식의견이 아님을 알려드립니다.
<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>

KOTRA의 저작물인 ([기고] 바이오의약품 할랄 인증의 이해)의 경우 ‘공공누리 제4 유형: 출처표시+상업적 이용금지+변경금지’ 조건에 따라 이용할 수 있습니다. 다만, 사진, 이미지의 경우 제3자에게 저작권이 있으므로 사용할 수 없습니다.
-
1
UAE 할랄 인증 현황
아랍에미리트 2020-08-11
-
2
할랄 가이드 ① 세계 할랄 시장의 허브, 말레이시아
말레이시아 2021-07-01
-
3
이제는 선택이 아닌 필수, 인도네시아 할랄 시장동향 살펴보기
인도네시아 2021-12-30
-
4
인도네시아 제약산업 정보
인도네시아 2020-12-23
-
5
인도네시아 반려동물 사료 시장동향
인도네시아 2021-12-20
-
6
2021 인도네시아 건설 산업 정보
인도네시아 2022-01-07
-
1
2021년 인도네시아 소비재 산업 정보
인도네시아 2022-01-10
-
2
2021년 인도네시아 기계 산업 정보
인도네시아 2022-01-10
-
3
2021 인도네시아 건설 산업 정보
인도네시아 2022-01-07
-
4
2021년 인도네시아 섬유산업 정보
인도네시아 2022-01-07
-
5
2021년 인도네시아 석유화학산업 정보
인도네시아 2021-12-28
-
6
2021년 인도네시아 신재생에너지 산업 정보
인도네시아 2021-10-25













