-
캐나다에 의료기기 수출하려면 이 정도는 알아야
- 트렌드
- 캐나다
- 토론토무역관 방지원
- 2018-09-25
- 출처 : KOTRA
-
- 안전성: 위험등급에 따라 제조업체, 유통업체 모두 면허 취득해야해 -
- 품질평가: 2019년부터 새로운 제도(MDSAP)로 전환 예정 -
□ 캐나다 의료기기 관련 법령 및 인증
◦ 캐나다는 의료기기의 수입·판매·홍보에 관련 사항을 식약품법(Food and Drugs Act) 및 의료기기규정(Medical Devices Regulations)에 따라 규제하고 있음
◦ 의료기기규정 Part 1은 각 의료기기별 일반 규제 사항을 명시하고 있으며, Part 2는 특별 용도로 제작·판매되는 의료기기에 대한 규제 사항, Part 3는 연구 및 조사용 의료기기에 대한 사항 명시
캐나다 의료기기규정 세부 사항(Part 1 기준)
섹 션
내 용
10~20
안전 및 효과
21~51
라벨링 및 라이센스
52~56
유통 기록
57~58
불만 관리 및 서류작업 절차
59~62
문제 의무 보고
63~65
제품 회수(리콜)
66~68
임플란트 등록
자료원: 캐나다 법무부, KOTRA 토론토 무역관 정리
◦ 캐나다에서 의료기기·용품 취급을 위해서는 캐나다 보건부(Health Canada)에서 발급하는 면허 취득이 필수임
- 의료기기 관련 면허는 크게 안전성 평가와 품질평가 두 가지로 나뉨
- 안전성을 검토하는 면허는, 제조업체가 취득해야 하는 면허(MDL, Medical Device Licence)와 이를 수입·판매하는 수입·유통업체가 취득해야 하는 면허(MDEL, Medical Device Establishment Licence)로 분류됨
- 품질평가의 경우 기존의 CMDCAS(Canadian Medical Devices Conformity Assessment System)와 새롭게 도입 예정인 MDSAP(Medical Device Single Audit Program) 두 가지가 있음
□ 제조업체 면허(MDL, Medical Device Licence)◦ 캐나다 내 의료기기·용품 판매를 위해서는 모든 제조업체가 MDL을 취득해야 함
- 보건부는 인체에 미치는 영향 및 위험도에 따라 의료기기·용품을 크게 네 가지 위험등급(Class I~IV)으로 분류
- Class I 제품은 신체에 미치는 영향이 미미한 제품들로서 MDL 취득이 불요하나, 고위험군 품목인 Class II~IV 제품은 MDL 취득이 필수임
- 제품별 등급에 대한 상세 정보는 캐나다 의료기기 규정(다음 링크) 참고(클릭 시 이동: Guidance for Industry- Keyword Index to Assist Manufacturers in Verifying the Class of Medical Devices)◦ MDL은 제조업체가 직접 신청하는 것이 원칙이나, 캐나다 수입업체가 제조업체의 권한을 위임받아 대리 신청하는 것도 가능함
MDL 등급 구분
구 분
위험도
해당 품목(예시)
I
매우 낮음
위생붕대, 칫솔, 병원 침대 등
II
낮음
교정용 세라믹 브라켓, 위생생리대, 수술용 장갑 등
III
보통
치과 복합레진, 골반대체 임플란트, 초음파 영상장치 등
IV
매우 높음
에이즈 측정기기, 이식형 제세동기, 이식박동 조율기 등
자료원: 캐나다 보건부(Health Canada)
◦ 이미 MDL이 부여된 의료기기에 대한 정보는 MDALL(Medical Devices Active Licence Listing)에서 확인 가능(참고: MDALL, 클릭 시 이동)
□ MDL 신청 절차 및 비용
◦ MDL 신청관련 업무는 캐나다 보건부(Health Canada) 산하 의료기기국(Medical Devices Bureau)의 기기면허과(Device Licensing Division)에서 관리
◦ MDL 신청서에는 의료기기·용품 위험 등급에 따라 크게 16~17가지 항목에 대한 정보 기재(참고: 캐나다 MDL 신청 가이드, 클릭 시 이동)
MDL 신청서 주요 항목(Class III 기준)
내 용
설 명
Name of the Device (as it appears on the label)
제품명(라벨에 있는 제품명과 동일하게 기재)
Manufacturer Information (as it appears on the label)
제품라벨에 기재된 의료기기 제조사의 회사명, 연락처, 해당 국가 등을 기재
Invoicing Information
상업송장에 기재된 정보
Quality Management System Certificate
제품 품질 관리 시스템 인증 보유 여부 확인
(인증 보유 시 품질 시스템 인증서 제출 필수)
Purpose/Intended Use of Device
의료기기 사용 목적 및 설명서 등 제품에 대한 상세 정보(캐나다 보건부에서 제품을 이해할 수 있도록 설명해야 함)
Place of Use
의료기기 사용 장소(Home Use 또는 In Vitro Diagnostic Device) 선택
Medical Devices Containing Drugs
의료기기에 함유된 의약품 정보 제공
Device History
과거에 판매 승인을 받은 적이 있는 의료기기인지를 확인하는 항목
Identifier of Device
제품 내 부속품, 악세서리 등 제품 식별 정보
Compatibility of Interdependent Devices
다른 Class II, III 또는 IV 의료기기와 함께 사용될 경우, 관련 의료기기에 대한 모든 정보를 제공해야함
자료원: 캐나다 보건부(Health Canada)
◦ 신청서는 기타 주요서류(Executive Summary, Device Testing Results, Labelling Material)와 함께 아래 주소로 발송
Manager, Device Licensing Division
Medical Devices Bureau
Therapeutic Products Directorate
Health Canada
2934 Baseline Road. Tower B
Address Locator 3403A
Ottawa, Ontario
K1A 0K9
◦ MDL 초기 신청비용은 제품의 위험 등급에 따라 최소 405 캐나다 달러에서 최대 2만 3,012 캐나다 달러까지 소요됨MDL 신청·변경 비용(2018년 4월 기준)
구 분
내 용
비용(C$)
Class II
Licence Application
405
Class III
Changes in Manufacturing
1,462
Significant Changes (not related to Manufacturing)
5,437
Licence Application
5,805
Licence Application (Near Patient In Vitro Diagnostic Devices)
9,881
Class IV
Changes in Manufacturing
1,462
Significant Changes (not related to Manufacturing)
6,195
Licence Application (Devices that contain human/animal tissue)
12,594
Licence Application
13,500
Licence Application (Near Patient In Vitro Diagnostic Devices)
23,012
자료원: 캐나다 보건부(Health Canada), Medical Device Licence Application Review(클릭 시 이동)
□ 수입·유통업체 면허(MDEL, Medical Device Establishment Licence)
◦ 캐나다의 수입·유통업체는 MDEL을 취득해야함
- 2018년 4월 기준, 초기 MDEL 신청에 소요되는 비용은 8,272 캐나다 달러임
- MDEL 신청서 및 관련 정보는 캐나다 보건부 웹사이트 참고(캐나다 보건부 MDEL 라이센스, 클릭 시 이동)◦ 의료기관, 소매업체, 의료기기 제조업체의 경우 MDEL 취득 제외 대상임
□ 의료기기 품질평가제도의 변경
◦ 2003년부터 시행된 의료기기규정(Medical Devices Regulations)에 의거해, 캐나다에서 의료기기 제조업자(Class I 제외)가 제품을 판매하기 위해서는 의료기기 품질경영시스템 인증인 ISO 13485 취득이 의무임
◦ 그동안 Class II, III, IV 의료기기에 대한 ISO 13485 품질시스템 심사는 ‘CMDCAS(Canadian Medical Devices Conformity Assessment System)’를 바탕으로 실시되어 왔음
- CMDCAS는 캐나다 내 시판되는 의료기기가 품질관리시스템에 따라 설계되고 제조되도록 캐나다 표준위원회(SCC, Standard Council of Canada)와 캐나다 보건부가 개발한 캐나다 의료기기 적합성 평가제도임
◦ 현재의 평가제도(CMDCAS)가 2019년 1월 1일부터 국제의료기기규제당국자포럼(IMDRF, International Medical Device Regulations Forum)이 운영하는 의료기기 단일심사 프로그램(MDSAP, Medical Device Single Audit Program)으로 전환됨
- MDSAP는 전 세계 의료기기 시장 점유율의 85%를 차지하고 있는 IMDRF 회원국 중 5개국(캐나다, 미국, 호주, 브라질, 일본)이 참여하는 국가 간 의료기기 품질관리기준(GMP) 상호인정 프로그램
- 캐나다는 2019년 이후 MDSAP를 취득하지 못한 의료기기 수입을 전면 금지할 예정- MDSAP를 취득할 경우 캐나다(Health Canada), 미국(FDA), 호주(TGA, Therapeutic Goods Administration), 브라질(ANVISA, Agância Nacional de Vigilância Sanitária), 일본(MHLW, Ministry of Health, Labour and Welfare) 5개국의 GMP 심사에 대해 전체 또는 일부 면제 가능
- CMDCAS를 보유한 제조사의 경우도 2019년 이후부터는 MDSAP가 필요함□ 참고: 의료기기 시장특성 및 유통구조
◦ 캐나다는 전 국민에게 대부분의 의료서비스를 무상으로 제공하는 보건 정책을 시행 중임
- 각 주는 연방정부로부터 예산을 받아 주 정부 차원의 독립적인 의료서비스 제공
- 비용절감을 위해 CT, MRI 등의 고가장비는 직접 대량으로 구매해 의료기관에 배분하기도 함캐나다 의료기기시장 유통구조
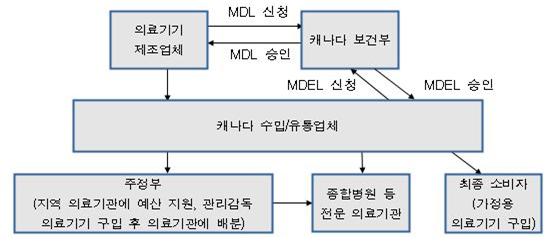
자료원: KOTRA 토론토 무역관 정리
□ 수출 시 주의 사항 및 시사점
◦ 미국 FDA 등 제3국으로부터 승인받아 이미 해외로 수출을 하고 있는 수출업체라도 캐나다 규제조건을 만족하지 못할 경우 캐나다 내 판매 불가능
◦ 수입·유통업체 또한 의료기기 관련 제품 취급을 위해서는 면허 취득이 의무이기 때문에 우리 기업은 바이어로부터 MDEL 취득 여부를 우선 확인해야 함
◦ 캐나다 의료기기 시장은 엄격한 규제로 신제품 도입과 시장 변화가 느린편
- 바이어는 토론토무역관 담당자와의 인터뷰에서 한국산 제품은 브랜드 인지도가 낮기 때문에 고위험군인 Class III, IV 보다는 Class II 제품 수출에 주력해 신뢰 향상에 초점을 맞추는 것이 필요하다고 조언함
- 또한, Class II 제품 수출이 시간·비용이 상대적으로 덜 소요되기 때문에 시장접근성이 좋다고 설명함
◦ 품질평가 제도의 변경시기가 얼마 남지 않아 캐나다 수출을 준비하고 있는 우리기업에 어려움이 예상됨
- 하지만, MDSAP 취득 시 의료기기 수출 심사과정이 간소화되기 때문에 수출 경쟁력을 갖출 수 있는 발판으로의 활용도 가능할 것으로 보임
- 특히 한국은 IMDRF의 10번째 가입 회원국으로, 이번 기회를 잘 활용하여 세계 주요시장 진출 기회를 모색해봐야 함◦ 이외 의료기기 면허 관련 문의는 아래 기기면허과를 접촉하거나 캐나다 보건부(Health Canada) 웹사이트 참조 요망(참고: 캐나다 보건부, 클릭 시 이동)
Device Licensing Division
Therapeutic Products Directorate
이메일: device_licensing@hc-sc.gc.ca
전화번호: +1-613-957-7285
팩스: +1-613-957-6345
자료원: 캐나다 법무부, 캐나다 국경관리청(CBSA), 캐나다 보건부(Health Canada), 캐나다 의료기기 바이어 인터뷰 및 KOTRA 토론토 무역관 보유 자료 종합
<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>

KOTRA의 저작물인 (캐나다에 의료기기 수출하려면 이 정도는 알아야)의 경우 ‘공공누리 제4 유형: 출처표시+상업적 이용금지+변경금지’ 조건에 따라 이용할 수 있습니다. 다만, 사진, 이미지의 경우 제3자에게 저작권이 있으므로 사용할 수 없습니다.
-
1
캐나다, 의료기기 인증절차
캐나다 2009-09-29
-
2
캐나다 의료기기 시장 동향
캐나다 2020-05-13
-
3
캐나다 의료기기 시장동향
캐나다 2022-08-08
-
4
만만치 않은 베트남 제약시장 진출
베트남 2017-02-20
-
5
포스트 코로나 시대, 캐나다 의료기기 시장 변화
캐나다 2021-11-08
-
6
캐나다, 의료기기 인증 대행업체가 설명하는 인증 획득절차
캐나다 2014-03-29
-
1
2021년 캐나다 건설 산업 정보
캐나다 2021-12-23
-
2
2021년 캐나다 신재생 에너지 산업 정보
캐나다 2021-12-23
-
3
2021년 캐나다 에너지 산업 정보
캐나다 2021-12-22
-
4
2021년 캐나다 농림수산식품 산업 정보
캐나다 2021-12-22
-
5
2021년 캐나다 인프라 산업 동향 및 전망
캐나다 2021-12-20
-
6
2021년 캐나다 산업 개관
캐나다 2021-12-02
- 이전글
- 다음글













